W organizmie człowieka znajduje się jak wiadomo więcej komórek obcych niż własnych. „Mikroby” kiedyś postrzegane były zdecydowanie pejoratywnie – jako patogeny chorobotwórcze. Jednak dzięki rozwojowi nauki doszło do radykalnej zmiany tego podejścia i od pewnego czasu mikroorganizmy znajdujące się w jelicie człowieka określa się wręcz jako drugi mózg. Biorąc pod uwagę fakt, że wagowo wszystkie komórki mózgu to łącznie około 500g (większość jego masy stanowi wszak woda), a w jelicie, jak się przyjmuje, znajduje się około 2 kg komórek bakteryjnych (w zależności od masy ciała i stanu zdrowia człowieka), trudno się dziwić, że mają one tak wielkie znaczenie, że życie bez nich nie byłoby możliwe.
Używa się różnych terminów związanych z „pożytecznymi bakteriami”, często wymiennie i bez wnikania w znaczenie różnych związanych z nimi pojęć.
Mikrobiom, mikrobiota, flora bakteryjna, najróżniejsze „biotyki” odmieniane akademicko przez wszystkie przypadki – probiotyki, prebiotyki, symbiotyki, fitobiotyki, psychobiotyki, parabiotyki i zwłaszcza ostatnio głośne się stały postbiotyki, gdyż do portfolio dołączyła ostatnio Akermansia muciniphila zarejestrowana jako postbiotyk właśnie.
Można się pogubić?
Wydaje się, że warto przyjrzeć się znaczeniu tych terminów i nieco je przybliżyć (wyczerpanie tematu zajęłoby kilka książek i jest poza zasięgiem tego artykułu.
Po kolei:
Mikrobiom to niezwykle szerokie pojęcie, w jego skład wchodzą wszystkie mikroorganizmy, ich geny i środowiska w których funkcjonują.
Mikrobiota, zwana również florą bakteryjną, jest zespołem mikroorganizmów takich jak bakterie, grzyby, wirusy, czy pierwotniaki zamieszkujące konkretne środowisko. Mówiąc mikrobiota najczęściej myśli się o środowisku przewodu pokarmowego człowieka, ale przecież istnieje mikrobiota skóry, jamy ustnej, nosa, układu moczowo-płciowego i inne. Reguluje ona metabolizm i homeostazę gospodarza, wpływając na funkcję endokrynną jelit, dojrzewanie układu odpornościowego, sygnalizację neurologiczną, modulację energetyczną, produkcję metabolitów funkcjonalnych i ochronę przed patogenami.
Mikrobiota i mikrobiom są ze sobą nierozerwalnie powiązane i jedno wpływa na drugie – mikrobiota na skład mikrobiomu, a mikrobiom na prawidłowe funkcjonowanie organizmu gospodarza. Można też sprawę zamknąć w jednym zdaniu: bez mikrobioty znane nam życie byłoby niemożliwe, gdyż pełni ona kluczowe funkcje metaboliczne, których organizmy żywe nie są w stanie wykonać samodzielnie. Jeżeli jest jej zbyt mało, lub w nieodpowiednich proporcjach i składzie (dysbioza) nieodmiennie pojawiają się liczne zaburzenia i choroby, wystarczy wymienić takie jak, choroby zapalne jelit, zespół jelita drażliwego, choroby autoimmunologiczne i metaboliczne, a to tylko kilka przykładów „z brzegu”. Wpływa ona na utrzymanie równowagi mikrobiologicznej organizmu, trawienie i wchłanianie składników odżywczych, odporność (wszyscy wiemy, że ponad 70% odporności jest w jelitach), syntezę witamin i hormonów, procesy metaboliczne i kontrolę zapalną.
Nie tylko niedobór, ale i nadmiar ma znaczenie.
Ubytek może przejawiać się pod postacią zaburzeń trawienia i przyswajania składników pokarmowych, biegunek, obniżenia odporności w postaci chorób autoimmunologicznych i metabolicznych, wśród których sztandarowe to cukrzyca, otyłość, choroby układu pokarmowego, skórne, zaburzenia odporności i infekcje i wiele innych. Wymaga on odpowiedniej suplementacji, a w ciężkich przypadkach transplantacji mikrobiomu. Nadreprezentacja poszczególnych mikroorganizmów też jest szkodliwa, przerost, czy przedawkowanie może przyjmować postać nudności, wymiotów, wzdęć, czy biegunki. Nadmierny rozrost flory bakteryjnej nazywany jest SIBO (ang. Small Intestin Bacterial Overgrowth) i leczony między innymi antybiotykami, lekami poprawiającymi motiorykę jelit, dietą oraz pro- i prebiotykami.
Kategoryzacja biotyków jest nadal przedmiotem badań, a niektóre z nich mogą przejawiać jednocześnie cechy kilku typów, co nie ułatwia klasyfikacji. Oto lista najważniejszych:
- Probiotyki są żywymi mikroorganizmami, wprowadzanymi do organizmu w celu poprawy składu mikrobioty jelitowej. Poprawiają trawienie, wzmacniając odporność redukują ryzyko infekcji, występowanie chorób autoimmunologicznych oraz zapalnych chorób jelit. Najczęściej stosowane to L. plantarum 299v, Lactobacillus rhamnosus GG, Bifidobacterium bifidum, Streptococcus thermophilus, Saccharomyces boulardi (4 pierwsze to bakterie, ostatnie grzyby).
- Prebiotyki to niestrawne składniki pokarmowe, służące jako pożywienie, zwiększające liczbę i aktywność korzystnych bakterii jelitowych. Mogą poprawiać funkcjonowanie układu pokarmowego, odpornościowego, a także mózgu, zmniejszając ryzyko chorób serca, czy cukrzycy. Najczęściej stosuje się fruktooligosacharydy – FOS, galaktooligosacharydy – GOS oraz inulinę i oligofruktozę.
- Symbiotyki (synbiotics) to połączenie w jednym preparacie probiotyków i prebiotyków działające synergicznie na korzyść mikroflory gospodarza (np. Bifidobacterium lactis BB-12 i mieszanina inuliny i FOS).
- Parabiotyki (paraprobiotics) to substancje zawierające elementy bakteryjne, nie będąc żywymi mikroorganizmami, są korzystne dla gospodarza mimo braku funkcji namnażania. Zmniejszają ryzyko chorób, poprzez modulowanie odpowiedzi immunologicznej. Najważniejsze z nich to bakterie kwasu mlekowego, związki chitosanu, białka i peptydy, przykładem może być inaktywowany Lactobacillus acidophilus czy fragmenty ściany komórkowej Bifidobacterium bifidum.
- Postbiotyki zawierają nieżywe/inaktywowane drobnoustroje i/lub ich składniki (produkty metabolizmu żywych bakterii), które wpływają korzystnie na funkcjonowanie mikrobioty, a tym samym zdrowie organizmu. Poprawiają one funkcjonowanie układu pokarmowego, odporność organizmu, metabolizm. Wyróżniające je cechy to: udowodnione bezpieczeństwo, celowa inaktywacja (np. pasteryzacja), postbiotyk nie musi pochodzić od probiotyku, ich korzystny wpływ na zdrowie musi być potwierdzony badaniami klinicznymi u gospodarza docelowego. Działanie nie ogranicza się do jelit, mogą być podawane doustnie, na skórę i błony śluzowe, ale nie iniekcyjnie, a oczyszczone produkty metabolizmu drobnoustrojów oraz szczepionki nie są postbiotykami. Przykładem bakterii zarejestrowanej jako postbiotyk jest Akermansia muciniphila. Do postbiotyków wg różnych autorów zalicza się takie substancje, jak kwas mlekowy, octowy, krótkołańcuchowe kwasy tłuszczowe, bakteriocyny, egzopolisacharydy, peptydy oraz białka, substancje te mogą być produkowane przez bakterie fermentujące, grzyby, bakteriofagi, a także komórki eukariotyczne na przykład ludzkie komórki nabłonkowe.
Różnica pomiędzy para- i postbiotykami wydaje się trochę nieostra i jest przedmiotem dyskusji akademickich. Z pewnością postbiotyki mają zdecydowanie większą ilość doniesień naukowych, podczas gdy parabiotyki to relatywnie nowe pole badań.
- Fitobiotyki – nazwa zarezerwowana dla roślinnego pochodzenia biotyków – to substancje roślinne mające wpływ na florę jelitową, zdrowie fizyczne, metabolizm, odporność i funkcje poznawcze. Występują w warzywach i owocach (np. buraki, cebula, czosnek, gruszki), są to między innymi polifenole, flawonoidy, czy terpenoidy.
- Psychobiotyki oznaczają żywe mikroorganizmy lub ich produkty, którym udowodniono korzystny wpływ na oś jelito-mózg (gut-brain axis), układ nerwowy, zdrowie psychiczne i emocjonalne, w tym na czynności poznawcze oraz na procesy zapalne związane z takimi chorobami jak depresja i zaburzenia lękowe. Wpływają one na produkcję neuroprzekaźników (jak dopamina, serotonina, noradrenalina). Sztandarowe psychobiotyki to np. Lactobacillus helveticus, czy Bifidobacterium longum (choć cechy psychobiotyku wykazuje też wymieniona wcześniej Akkermansia muciniphila)
Właśnie Akkermansji warto obecnie poświęcić kilka słów, choćby z tego powodu, że w kwietniu 2023 została zarejestrowana na świecie i w Polsce (jesteśmy w czołówce!).
Czym jest?
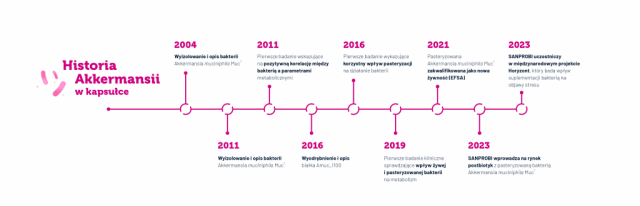
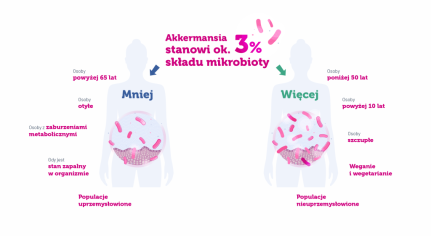
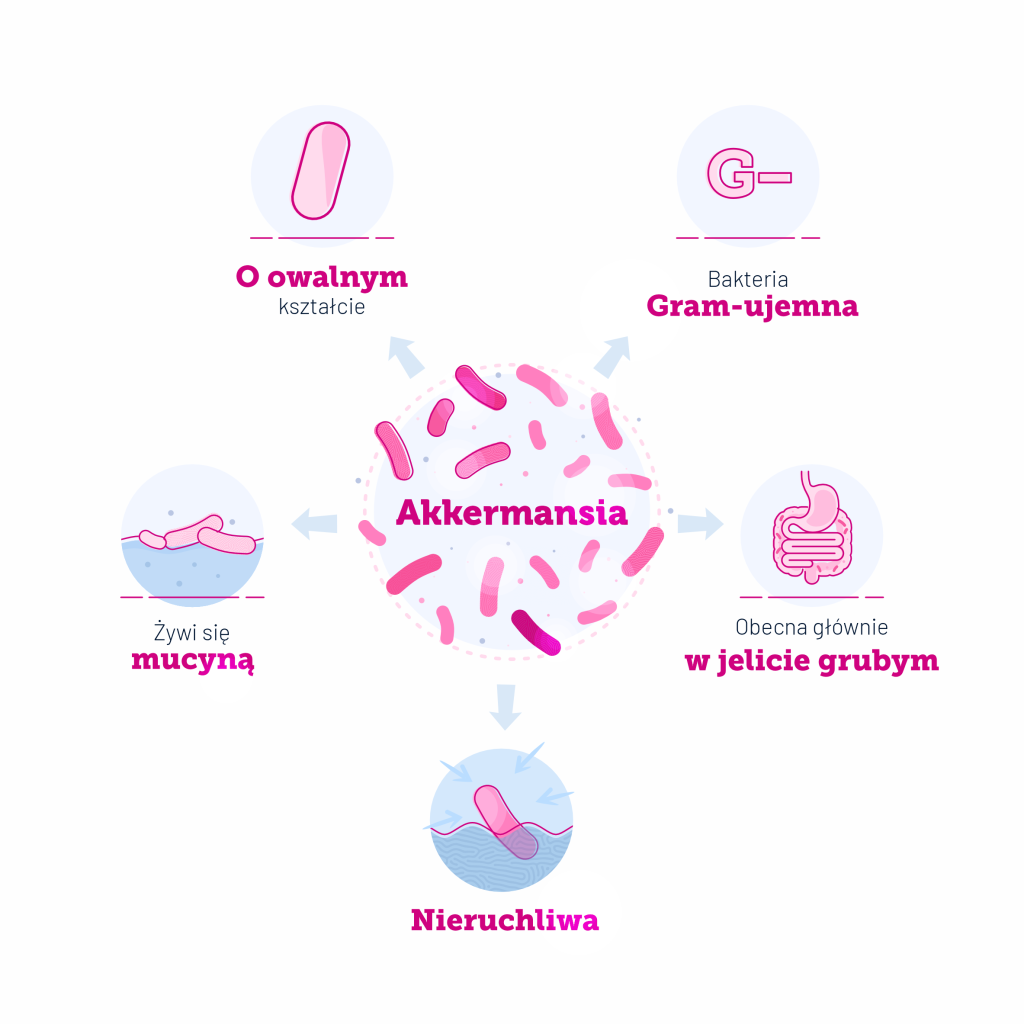
Akkermansia muciniphila (A. muciniphila) nazwana została „pożytecznym mikroorganizmem nowej generacji”, a pasteryzowana została w 2021 roku certyfikowana przez Urząd ds. Bezpieczeństwa Żywności (EFSA – ang.: European Fod Safety Authorization) jako „nowa żywność” i w kwietniu 2023 wprowadzona równolegle na rynek światowy i polski. Ale historia zaczęła się jakieś 18 lat wcześniej, kiedy to ta jest Gram-ujemna, nieruchliwa bakteria, została wyizolowana z kału przez wybitnych badaczy mikrobiomu prof. de Vosa i prof. Cani w roku 2004. Jest to beztlenowy bakteroid naturalnie występujący w jelicie ludzi i zwierząt, żywiący się wyłącznie rozkładaną przez siebie wyściełającą jelita mucyną, czyli śluzem. Na marginesie mucyna jest glikoproteiną produkowaną w jelicie przez komórki kubkowe (Gobleta). A. muciniphila stanowi około 1-3% mikrobioty jelitowej człowieka, nie występuje u noworodka, ale szybko jej ilość rośnie już u niemowląt, będąc istotnym składnikiem mikroflory osób długowiecznych (ponad 100 letnich) – stąd uznawana bywa za marker długowieczności.
Od jej wyodrębnienia została przedmiotem ponad 1100 publikacji naukowych, co pozycjonuje ją jako nie tylko ciekawą, ale jedną z najlepiej poznanych bakterii mikrobioty. Jednak ze względu na jej nietrwałość (wynikającą z beztlenowego charakteru i niestabilności termicznej), problemem było jej przechowywanie i trudności z klinicznym zastosowaniem formy natywnej. Rozwiązaniem okazała się pasteryzacja – czyli celowe termiczne uśmiercenie bakterii – a kolejne badania wykazały, że pasteryzacja nie tylko nie zmniejsza jej pożytecznych właściwości, ale je zwiększa oraz powoduje odtworzenie funkcji biologicznych żywych bakterii organizmu. W ten sposób bakteria komensalna, probiotyk, została postbiotykiem, a przynajmniej w tej formie się ją podaje. W roku 2017 dowiedziono (Plovier i wsp.), że za korzystne działanie tej bakterii odpowiada niezwykłe ciekawe białko Amuc_1100, aktywny składnik jej błony zewnętrznej, które zachowuje swoje właściwości i konformację także po pasteryzacji i aktywuje receptory TLR 2 i TLR4 (tzw. TLR, ang.: toll like receptors) odpowiedzialne za rozpoznawanie bakterii, wpływające na metabolizm i homeostazę jelitową. Ponadto okazało się (Yoon i wsp., 2021), że wydzielane przez A. muciniphila białko o nazwie P9, zwiększa ogólnoustrojowe wydzielanie GLP-1 (peptyd glukagonopodobny 1, ang. glucogon-like peptide 1), co może wspomagać walkę z chorobami metabolicznymi przez poprawę tolerancji glukozy i zmniejszanie i zapobieganie otyłości. Okazało się, że poziom A. miciniphila jest obniżony w kilku chorobach metabolicznych, w tym w otyłości, cukrzycy typu 2, chorobach sercowo-naczyniowych i niealkoholowej chorobie wątroby, a liczne badania wykazały, że żywa lub pasteryzowana Akkermansia i jej różne składowe zmniejszają masę ciała i przyrost tkanki tłuszczowej, regulują barierę jelitową i homeostazę glukozy. Wymaga to oczywiście kontynuacji prowadzonych badań, ale ze względu na udowodnione bezpieczeństwo i praktycznie brak objawów ubocznych w zalecanej dawce, jest też obiecującą alternatywą dla leków wykazujących przecież liczne objawy uboczne. Jest to szczególnie interesujące dla pacjentów walczących z nadwagą i otyłością, którzy nie rozwinęli jeszcze klinicznych manifestacji chorób sercowo-naczyniowych, czy cukrzycy, a którzy sięgają w sposób niekontrolowany po leki przeznaczone dla osób chorych na cukrzycę aby się odchudzić, co może narażać ich na ciężkie niekiedy objawy uboczne. Akkermansia może być dla nich bardzo dobrym rozwiązaniem.
To trochę tłumaczy po co tyle zachodu o jedną małą owalną, chciałoby się powiedzieć leniwą („nieruchliwą”) małą bakterię. Reasumując w dużym uproszczeniu do głównych korzystnych dla człowieka właściwości Akkermansii zalicza się następujące:
– zmniejszenie insulinooporności i poprawę metabolizmu glukozy (obniżenie poziomu glukozy na czczo) – bez stosowania modyfikacji diety (czyli bez restrykcji dietetycznych)
– zmniejszenie ryzyka rozwoju cukrzycy (typu I i II) i poprawę skuteczności leków przeciwcukrzycowych (jak Metformina)
– zmniejszenie masy ciała u osób otyłych i lepsza reakcja na ograniczenia kaloryczne w diecie
– zmniejszenie poziomu cholesterolu całkowitego i trójglicerydów w osoczu, wpływ na dyslipidemie
– działanie ochronne w rozwoju chorób sercowo-naczyniowych bezpośrednio lub poprzez wytwarzane metabolity i
współdziałanie z innymi bakteriami gospodarza
– korzystny wpływ na metabolizm lipidów w wątrobie, obniżenie aminotransferaz ALAT (ALT) i AspAT (AST) i łagodzenie przewlekłej choroby wątroby i wątrobowej manifestacji zespołu metabolicznego
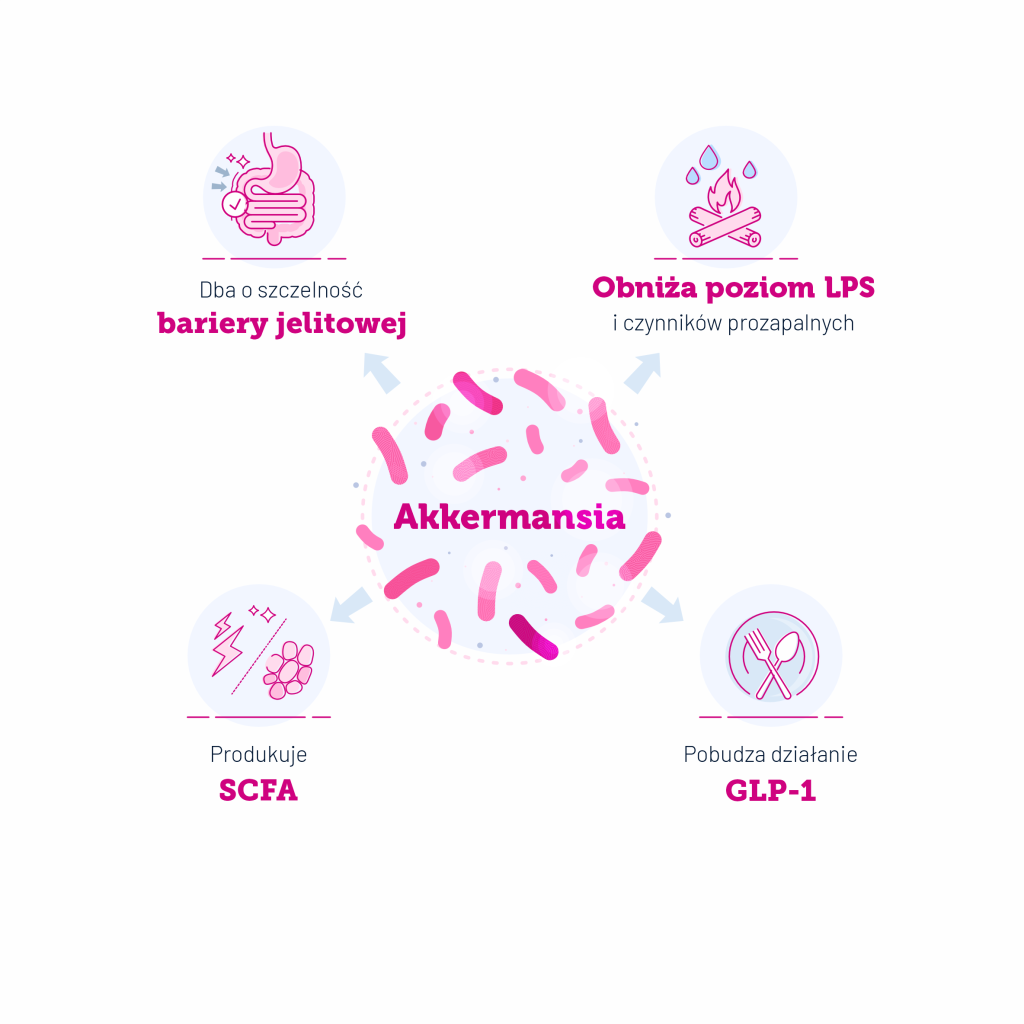
– produkcja krótkołańcuchowych kwasów tłuszczowych (SCFAs) – propionianu, octanu i maślanu, korzystnych dla homeostazy jelita (temat na kolejny arykuł)
– produkcja witaminy B12 (niezbędna do produkcji propionianu z bursztynianu przez A. muciniphila)
– udział w utrzymaniu integralności bariery
jelitowej, zmniejszeniu reakcji zapalnej organizmu i dysfunkcji osi mózgowo-jelitowej
– jest zaliczana do psychobiotyków (w pracach badawczych wykazano korzystne działanie w chorobie Alzheimera, autyzmie, stwardnieniu rozsianym, chorobie Parkinsona i in.)
Ze względu na jej właściwości w jednym z artykułów zadano pytanie (Yan i wsp., 2021) czy Akkermansia muciniphila okaże się świętym Gralem w walce z chorobami metabolicznymi. Oczywiście nadal prowadzone są liczne badania, które być może na to pytanie odpowiedzą.
Piśmiennictwo
Derrien M, Vaughan EE, Plugge CM, de Vos WM. Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium. Int J Syst Evol Microbiol. 2004;54:1469–76.
Cani PD, Depommier C, Derrien M, Everard A, de Vos WM. Akkermansia muciniphila: paradigm for next-generation beneficial microorganisms. Nat Rev Gastroenterol Hepatol. 2022;19:625–37
Plovier H, Everard A, Druart C, Depommier C, Van Hul M, Geurts L, i in. A purified membrane protein from Akkermansia muciniphila or the pasteurized bacterium improves metabolism in obese and diabetic mice. Nat Med. 2017;23:107–13.
Yoon HS, Cho CH, Yun MS, Jang SJ, You HJ, Kim J-H, i in. Akkermansia muciniphila secretes a glucagon-like peptide-1-inducing protein that improves glucose homeostasis and ameliorates metabolic disease in mice. Nat Microbiol. 2021;6:563–73.
Yan J, Sheng L, Li H. Akkermansia muciniphila: is it the Holy Grail for ameliorating metabolic diseases? Gut Microbes 2021, Vol. 13, No 1, e1984104 (30 pages).
Depommier C, Everard A, Druart C, Plovier H, Van Hul M, Vieira-Silva S, i in. Supplementation with Akkermansia muciniphila in overweight and obese human volunteers: a proof-of-concept exploratory study. Nat Med. 2019;25:1096–103
Collado MC, Derrien M, Isolauri E, de Vos WM, Salminen S. Intestinal integrity and Akkermansia muciniphila, a mucin-degrading member of the intestinal microbiota present in infants, adults, and the elderly. Appl Environ Microbiol. 2007;73:7767–70.
Biagi E, Franceschi C, Rampelli S, Severgnini M, Ostan R, Turroni S, i in. Gut Microbiota and Extreme Longevity. Curr Biol. 2016;26:1480–5.
Łoniewski I, Skonieczna-Żydecka K. Monografia Sanprobi Premium – The Akkermansia Company. 2023
 dr n. med. Monika Łącka
dr n. med. Monika Łącka
Absolwentka AM w Poznaniu, specjalista chorób wewnętrznych, lekarz medycyny estetycznej, wykładowca akademicki (Studia Podyplomowe Estetyka Twarzy przy UM w Poznaniu, Studia Podyplomowe Medycyna Estetyczna przy ANSM w Poznaniu oraz Studia Podyplomowe Akademia Medycyny Estetycznej i Biznesu przy ALK w Warszawie). Członek Zarządu PTMEiAA, członek Aesthetic Multispeciality Society International (AMS), Prezes Zarządu Głównego Polskiego Towarzystwa Lekarzy Estetyki Twarzy przy UM im. Karola Marcinkowskiego w Poznaniu, Członek Zarządu Polsko-Niemieckiego Towarzystwa Medycyny Estetycznej i Anti-Aging





